espace pédagogique > disciplines du second degré > biotechnologies-santé-social > ressources pédagogiques
cytométrie en flux
mis à jour le 07/11/2014
utilisation pédagogique d'un film de la Science en cours présentant la technique automatisée de dénombrement et d'identification cellulaire
mots clés : cytométrie, flux, dénombrement, cellules , BP PP, BTS ABM, BTS Biotechnologies, BTS BioAC, STL, laboratoire, médico-tech
Utilisation pédagogique d'une vidéo
Le film comporte plusieurs séquences permettant leur utilisation en pointillé au fil d'un cours sur la cytométrie de flux :
- Présentation du principe général
- Le système fluidique
- Le système optique
- Le système informatique
- La préparation des échantillons
- Les réglages
- L'enregistrement et les analyses des données
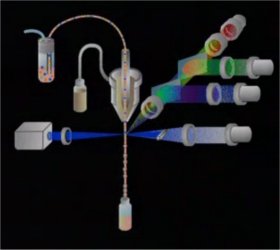
 2 - Le système fluidique (à 1 min 26)
2 - Le système fluidique (à 1 min 26)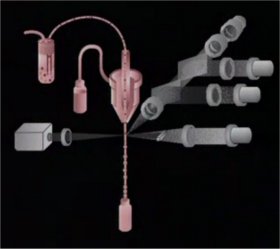 Il permet d'aspirer la suspension cellulaire dans la chambre d'analyse.
Il permet d'aspirer la suspension cellulaire dans la chambre d'analyse. L'hydrofocalisation produit son entrainement passif grâce à un second flux de gainage et permet un alignement et un défilé à grande vitesse des cellules une à une devant le système optique de détection.
Les cellules sont ensuite, soit triées et récupérées, soit éliminées.
 3 - Le système optique (à 2 min 28)
3 - Le système optique (à 2 min 28)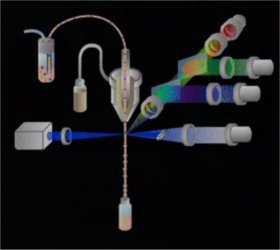 Il est constitué de la source lumineuse LASER ( monochromatisme) et un jeu de filtres et miroirs qui permettent le cheminement de la lumière diffusée par les cellules jusqu'aux photodétecteurs convertissant l'influx lumineux en signal électrique.
Il est constitué de la source lumineuse LASER ( monochromatisme) et un jeu de filtres et miroirs qui permettent le cheminement de la lumière diffusée par les cellules jusqu'aux photodétecteurs convertissant l'influx lumineux en signal électrique. L'interaction du faisceau avec la cellule dévie une partie de la lumière. La mesure de la lumière diffusée se fait selon le même axe pour mesurer la taille ou selon un axe à 90° pour mesurer la structure du noyau et la présence de granules internes.
 4 - Le système informatique (à 4 min 07)
4 - Le système informatique (à 4 min 07) Le signal recueilli par les photodétecteurs est numérisé, stocké et analysé.
Le signal recueilli par les photodétecteurs est numérisé, stocké et analysé.La présentation des résultats se fait sous forme de graphiques, histogrammes bi ou multiparamétriques qui font apparaitre sous forme de points les différentes populations cellulaires.
 5 - La préparation des échantillons (à 8 min 55)
5 - La préparation des échantillons (à 8 min 55)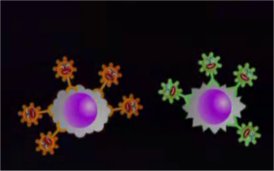 Elle consiste en un marquage préliminaire direct des cellules par une combinaison d'anticorps monoclonaux marqués par des fluorochromes.
Elle consiste en un marquage préliminaire direct des cellules par une combinaison d'anticorps monoclonaux marqués par des fluorochromes.  6 - Les réglages (à 11 min 19)
6 - Les réglages (à 11 min 19)- alignement du cytomètre à l'aide de billes de latex calibrées fluorescentes,
- réglages des photomultiplicateurs afin de limiter la saturation due aux forts signaux et de détecter les plus faibles,
- compensation de fluorescence lors de l'utilisation simultanée de plusieurs fluorochromes.
 7 - L'enregistrement et les analyses des données (à 13 min 47)
7 - L'enregistrement et les analyses des données (à 13 min 47)Après avoir défini des seuils de positivité, il y aura, dans ces populations cibles, recherche de l'expression de marqueurs qui permettra l'identification et la quantification de sous populations comme celles des LT CD4+ et LT CD8+ dans le suivi des infections par le virus de l'immunodéficience humaine (VIH).
information(s) pédagogique(s)
niveau : brevet professionnel, bts, Terminale STL
type pédagogique : démarche pédagogique, leçon, connaissances
public visé : enseignant, élève, étudiant
contexte d'usage : classe, salle multimedia, travail autonome
référence aux programmes : référentiel des diplômes des filières
- laboratoire :
- Brevets de Technicien Supérieur Analyses de BIologie Médicale, Bioanalyses et Contrôles et Biotechnologies
- Baccalauréat STL spécialité Biotechnologies
- médicotechnique : Brevet Professionnel Préparateur en Pharmacie
fichier joint
information(s) technique(s) : lien avec la vidéo sur le site du CERIMES
biotechnologies-santé-social - Rectorat de l'Académie de Nantes

 s'identifier
s'identifier
 portail personnel ETNA
portail personnel ETNA