espace pédagogique > disciplines du second degré > physique chimie > mutualisation > travail collaboratif
énergie d'activation d'une réaction
mis à jour le 24/01/2012
Démarche active pour interpréter l'évolution d'un système chimique à partir de l'énergie potentielle électrostatique des états successifs de ce système.
mots clés : DA, démarche active, énergie, potentielle, profil, réactionnel
But : Décrire l'évolution de l'énergie d'un système à l'aide d'un profil réactionnel.
Document 1 :
L'énergie Ep d'un système chimique correspond à l'énergie potentielle électrostatique qui existe entre les noyaux des atomes et les électrons des réactifs ou des produits qui sont situés très loin les uns des autres.
La variation 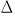 Ep d'énergie au cours d'une réaction s'écrit :
Ep d'énergie au cours d'une réaction s'écrit : 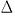 Ep = Epfinale des produits - Epintiale des réactifs
Ep = Epfinale des produits - Epintiale des réactifs
Une réaction chimique est exothermique si le système chimique concerné cède de l'énergie à l'extérieur, c'est-à-dire que Ep < 0 J.
Une réaction chimique est endothermique si le système chimique concerné reçoit de l'énergie de l'extérieur, c'est-à-dire que Ep > 0 J.
Une réaction chimique est athermique s'il n'y a pas d'échange d'énergie avec l'extérieur, c'est-à-dire que Ep = 0 J.
Au cours d'une réaction chimique :
- certaines liaisons sont en cours de formation ou de rupture ce qui donne lieu à des états de transition notés « ET », dont l'énergie correspond à des maximas (il peut y en avoir plusieurs),
- des intermédiaires réactionnels notés « IR », dont l'énergie correspond à des minimas, peuvent se former et interagir avec les réactifs.
L'énergie d'activation Ea est l'énergie cinétique minimale que doivent avoir initialement les réactifs et/ou un IR et un réactif qui se rencontrent pour donner lieu à un choc réactif (il peut y en avoir plusieurs).
Le profil réactionnel représente le chemin réactionnel « le plus économique » pour aller des réactifs aux produits. Animation « courbe1.swf » Animation « courbe2.swf »
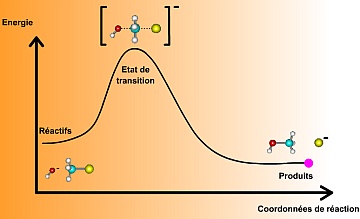
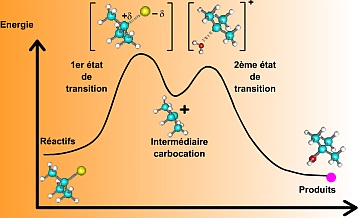
Document 2 : profils réactionnels ou variation de l'énergie potentielle du système au cours de la réaction.
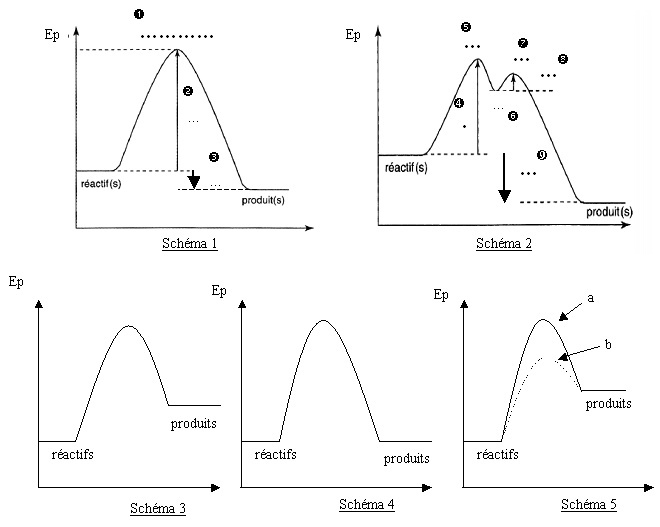
Questions :
- À l'aide des documents et des animations courbe1.swf et courbe2.swf , compléter les pointillés 1 à 9 des schémas du document 2 en utilisant les grandeurs du document 1 et les deux animations.
- Associer, dans un tableau, les différents profils réactionnels des schémas 1, 3 et 4 avec le type de réactions (exothermique, endothermique ou athermique) en justifiant brièvement votre choix.
- Sur le document 5 , quelle réaction est la plus facile à réaliser (justifier la réponse) ?
information(s) pédagogique(s)
niveau : 1ère STL
type pédagogique : travaux pratiques
public visé : élève
contexte d'usage : laboratoire
référence aux programmes :
Module chimie
fichier joint
information(s) technique(s) : Fichier modifiable au format . doc
taille : 75 kio ;
ressource(s) principale(s)

|
démarches actives | 09/02/2011 |
| documents présentés lors des stages "démarches actives" en sciences physiques à destination des professeurs de lycées, et exemples de séances ayant mis en application ces préconisations péda ... | ||
| nouveaux programmes, lycée, investigation, DA, pédagogie, TP, physique, chimie, stage, démarche active | ||

|
programme 2011 de 1ère STL - option SPCL | 18/09/2011 |
| un dossier complet sur le programme 2011 de classe de première de la série STL (option Sciences Physiques et Chimiques en Laboratoire). | ||
| réforme,1STL, 1SPCL, labo | ||
physique chimie - Rectorat de l'Académie de Nantes

 s'identifier
s'identifier
 portail personnel ETNA
portail personnel ETNA