espace pédagogique > disciplines du second degré > svt > enseignement > lycée > Spécialité SVT > terminale > vie fixée chez les plantes
action des hormones végétales sur la morphogénèse.
mis à jour le 10/02/2005
Des manipulations montrant les actions de l'auxine et de la cytokinine sur le développement de cals d'endive.
mots clés : hormones, auxine, cytokinine, culture in-vitro, cals, laboratoire, endive
Matériel nécessaire.
Première étape : la production de cals.
Deuxième étape : culture sur des milieux différents.
Résultats obtenus.
Proposition d'organisation .
Matériel nécessaire pour la réalisation des différentes étapes de la manipulation.
- verrerie et petits matériels (voir organisation
paillasse) - pince passée à l'alcool et rincée
à l'eau stérile avant chaque utilisation, gants en polyéthylène
désinfectés à l'alcool à 70° avant usage...
- Macroéléments : milieu de Murashige et Skoog dilué 2 fois - SIGMA propose ce milieu concentré 10 fois (réf :M0654), très pratique.
- Oligoéléments : milieu de Murashige et Skoog dilué 2 fois - SIGMA propose ce milieu concentré 10 fois (réf :M0529), très pratique.
- Vitamines : hydrosol polyvitaminé Roche (en pharmacie) 0,5ml/l, il existe d'autres solutions polyvitaminées (ex: Alvityl) qui servent de compléments alimentaires pour jeunes enfants.
- Eléments organiques : saccharose 20 g/l
- Gélifiant : agar-agar 8 g/l
- Régulateurs de croissance :
- auxine : choisir de préférence ANA (disponible chez JEULIN) qui reste très stable à la lumière et au chauffage - réaliser une solution à 1 mg par ml dans de l'alcool à 70° ( 100mg d' ANA pour 100 ml d'alcool à 70°.) -
- cytokinine (BAP) (disponible chez JEULIN) : réaliser une solution
à 1 mg par ml dans de la soude 0,1N (100 mg de BAP pour 100ml
de solution de soude)
Première
étape : la production de cals.
Cette étape est réalisée au laboratoire.
Manipulation en milieu stérile. Il faut compter 3 à 4 semaines
pour avoir assez de cals.
Préparation du milieu de culture
:
- Dissoudre le sucre dans la solution minérale, la verser dans un bécher en pyrex ou en inoxydable, ajouter l'agar-agar en pluie, attendre 3 à 4 minutes que l'agar-agar gonfle.
- Porter à ébulition à feu doux, en agitant constamment jusqu'à ce que le mélange soit homogène et limpide.
- Attendre 7 à 8 minutes que la température baisse, puis ajouter
:
-2 ml de la solution d'ANA(=2 mg par litre)
-2 ml de la solution de BAP(=2 mg par litre)
-0,5ml de la solution polyvitaminée
-
Homogénéiser, couler le milieu de culture dans les tubes et stériliser. Les tubes peuvent se conserver plusieurs jours au réfrigérateur.
Préparation de la
paillasse et mise en culture :

- éliminer la première couronne de feuilles de l'endive, prélever les feuilles sur les deux ou trois couronnes suivantes.
- les feuilles sont désinfectées 10 minutes dans un bain de Domestos dilué 5 fois.
- les feuilles sont ensuite rincées dans 3 bains successifs d'eau stérile.
- elles sont enfin déposées dans un autre bain d'eau stérile
avant de prélever les explants.
- les explants sont prélevés dans la partie médiane des feuilles(15mm x 30mm).
- la polarité des tissus doit être respectée : repiquer la base de la feuille.
- utiliser un scalpel très bien affuté de façon à
ne pas écraser les vaisseaux du bois.

Stockage des cultures et obtention des cals :
- une température stable de 20° à 22° semble convenir, éviter les écarts trop importants
- il faut trois à quatre semaines pour avoir assez de cal.

Deuxième étape
: cultures sur des milieux différents.
La division des cals :
Au bout de trois à quatre semaines, les cals sont sortis des tubes et
fragmentés en unités qui seront repiquées par les élèves.Cette
manipulation est très délicate : le cal se casse assez facilement.

Composition des milieux de culture :
- les macroéléments : identique à l'étape 1
- les oligoéléments : identique à l'étape 1
- éléments organiques : identique à l'étape 1
- vitamines : identique à l'étape 1
- gélifiant : identique à l'étape 1
- régulateurs de croissance : concentration variable suivant les
milieux :
|
ANA (auxine) en mg/l |
BAP (cytokinine) en mg/l
|
|
|
0
|
0
|
|
|
0
|
2
|
|
|
1
|
2
|
|
|
2
|
0
|
|
|
2
|
2
|
PAS de stérilisation du matériel végétal : les cals sont déjà stériles, ils sont sortis et divisés sous la hotte stérile (ou dans un environnement stérile), ils sont déposés dans des boites de pétri stériles pour attendre la mise en culture.
Cette étape peut être réalisée par les élèves si on dispose de suffisamment de cals.
La mise en culture est très délicate :
- les cals sont fragiles, ils ne doivent pas être trop sérrés avec la pince.
- les cals ne doivent pas être enfoncés profondément
mais seuleument mis en contact avec le milieu.

Stockage des cultures :
- une température stable de 20° à 22° convient très bien, il faut absolument éviter les écarts trop importants
- une photopériode de 8h à 10h de lumière par jour semble satisfaisante.
- il faut un minimum de deux à trois semaines pour avoir des résultats significatifs.
 |
 |
|
Culture 1 |
 |
 |
|
Culture 2 |
 |
 |
|
Culture 3 |
 |
 |
|
Culture 4 |
 |
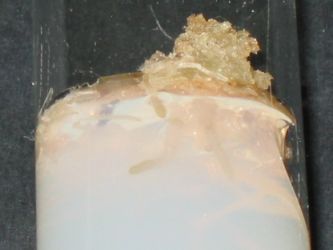 |
|
Culture 5 |
Proposition d'organisation
:
Organisation matérielle pour une classe
:
|
Etapes
|
Nombre de tubes (24 X 150)
avec milieu à prévoir
|
| Etape1 : Production du cal |
40 tubes permettent d'espérer environ 80 fragments
de cal
|
| Etape 2 : culture du cal sur différents milieux |
10 pour chaque milieux = 50 tubes
|
Plannification :
|
J : Lancement de la manipulation
|
J + 3 à 4 semaines
|
J + 5 à 7 semaines
|
|
| Réalisation au laboratoire |
1-préparation du milieu de culture pour cals 2-mise en culture des explants 3-stockage des cultures |
1-préparation des différents milieux de culture 1, 2, 3, 4, 5. 2-fragmentation des cals 3-stockage des cultures une fois celles-ci réalisées |
|
| Réalisation par les élèves |
1-mise en culture des cals sur les différents milieux 2-réalisation d'autres manipulations (voir les autres ateliers proposés ci-dessous) |
1-observation des cultures 2-interprétation des résultats obtenus |
- 1/4 de la classe réalise cette manipulation.
- 1/4 travaille sur l'origine et le rôle de l'auxine
- 1/4 de la classe travaille sur les tissus cible de l'hormone
Alain Charbonnel, technicien de laboratoire au lycée Guist'hau à NantesDominique Alvarez, professeur de SVT au lycée Guist'hau à NantesFrédéric Roux, professeur de SVT au Lycée du Pays de Retz à Pornic
information(s) pédagogique(s)
niveau : 1ère S
type pédagogique : démarche pédagogique, activité de recherche, travaux pratiques
public visé : enseignant, élève, personnel de laboratoire
contexte d'usage : atelier, classe, laboratoire
référence aux programmes :
La morphogenèse végétale et l'établissement du phénotype
fichier joint
information(s) technique(s) : fichier zip à décompresser
taille : 711 ko ;
sciences de la vie et de la Terre - Rectorat de l'Académie de Nantes

 s'identifier
s'identifier
 portail personnel ETNA
portail personnel ETNA
