espace pédagogique > disciplines du second degré > physique chimie > mutualisation > travail collaboratif
distillations simple et fractionnée
mis à jour le 03/10/2011
mots clés : séparation, ébullition, condensation, température, azéotrope, vigreux
![Accueil [legende-image]1424145810101[/legende-image]](https://www.pedagogie.ac-nantes.fr/medias/photo/accueil-pc_1560080380675-jpg?ID_FICHE=545356) |
Accueil | ![numérique [legende-image]1424145810107[/legende-image]](https://www.pedagogie.ac-nantes.fr/medias/photo/numerique_1560081272508-jpg?ID_FICHE=545356) |
Numérique | ![collège [legende-image]1424145810109[/legende-image]](https://www.pedagogie.ac-nantes.fr/medias/photo/college-2016_1560081636373-jpg?ID_FICHE=545356) |
Collège | ![enseigner [legende-image]1424145810102[/legende-image]](https://www.pedagogie.ac-nantes.fr/medias/photo/rechercher-des-ressources-pedagogiques_1560080503885-jpg?ID_FICHE=545356) |
Enseigner | ![se former [legende-image]1424145810108[/legende-image]](https://www.pedagogie.ac-nantes.fr/medias/photo/carre-jaune_1560081466520-jpg?ID_FICHE=545356) |
Se former | ![s'informer [legende-image]1424145810103[/legende-image]](https://www.pedagogie.ac-nantes.fr/medias/photo/les-dernieres-actualites_1560080612518-jpg?ID_FICHE=545356) |
S'informer | ![lycée [legende-image]1424145810098[/legende-image]](https://www.pedagogie.ac-nantes.fr/medias/photo/nouveau-lycee-2019_1560079683815-jpg?ID_FICHE=147469) |
Lycée |
La distillation est une technique de séparation importante pour le chimiste organicien.
Elle est également très utile en chimie minérale chaque fois que les constituants à séparer peuvent être transformés en composés volatils.
La technique de distillation est basée sur le principe élémentaire qui dit que dans un mélange, « c'est le composé le plus volatil qui s'évapore en premier ».
Elle peut être réalisée de plusieurs façons selon plusieurs critères.
Elle se résume en deux actions :
- Chauffer un liquide impur ou un mélange de liquides pour les transformer en vapeurs par ébullition.
- Condenser ensuite les vapeurs par refroidissement et isoler les liquides purs.
Il existe différentes techniques de distillation, mais nous n'en aborderons que deux, fréquemment utilisées et simples à mettre en œuvre.
1. La distillation simple sous pression atmosphérique : (sans colonne)
Le liquide et la vapeur sont au contact de l'air. La méthode est surtout appliquée à la purification des solvants volatils ou des composés ayant des températures d'ébullition très différentes.
2. La distillation fractionnée sous pression atmosphérique : (avec colonne)
Le mélange de liquides et de vapeurs est au contact de l'air. La distillation fractionnée, aussi appelée rectification, est un procédé de séparation qui permet aussi (comme la distillation simple) de séparer les différents constituants d'un mélange de liquides miscibles, possédant des températures d'ébullition différentes. Mais elle se distingue par l'utilisation d'une colonne de séparation, qui permet une meilleure séparation des constituants du mélange.
Montage :
Le montage se fait en partant du support élévateur puis du ballon de réaction et en déposant successivement la tête de distillation, le réfrigérant, l'allonge puis le récipient.
Le démontage se fera dans l'ordre inverse.
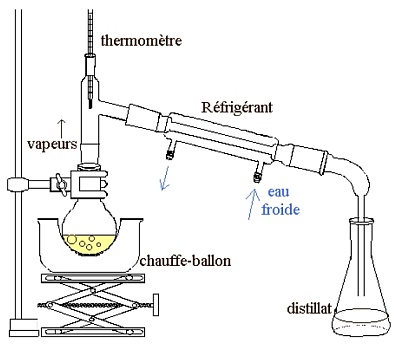
Sur ce schéma, il faut ajouter en plus une pince sur potence pour « maintenir » le réfrigérant.
Le matériel nécessaire est donc :
- Un plateau élévateur (quel peut-être son rôle ?)
- Un ballon rodé de 250ml.
- Un chauffe-ballon électrique avec agitation magnétique et barreau ovoïde
- Une tête de distillation
- Un thermomètre
- Un réfrigérant droit qui condense les vapeurs
- Une allonge à distiller
- Une ou des éprouvettes de récupération du distillat (100ml)
- Deux « pinces »
- Deux potences avec pinces.
Manipulation : en binôme
La moitié des groupes fait cette distillation simple avec un mélange à 50/50 d'eau et d'acétone. L'autre moitié des groupes fera la distillation fractionnée expliquée ci-après.
1. Introduire dans le ballon 100ml du mélange à distiller.
2. Effectuer la distillation : il doit s'écouler une goutte par seconde. Le réglage s'effectue grâce à l'élévateur.
3. Noter la température de départ à froid et dès la première goutte.
4. Noter la température tous les 5mL de distillat recueilli.
Vous essaierez de recueillir l'acétone dans une première éprouvette graduée et l'eau dans une seconde éprouvette graduée !
Conseil : Faites -vous aider de votre enseignant ! Il ne sera pas facile de savoir quand changer d'éprouvette !
Compte rendu :
Cf le compte rendu ci-dessous page 5 après la distillation fractionnée.
Vous prendrez soin de bien observer la différence de montage entre les deux distillations !
Quand il est demandé de faire une distillation, cela sous-entend qu'elle doit être simple
Quand il est demandé de faire une purification d'un corps par rectification, cela sous-entend qu'il faut faire une distillation fractionnée. On utilise le terme rectifier.
Principe :
La solution liquide est chauffée lentement jusqu'à ébullition. Cette ébullition correspond à la vaporisation du composé le plus volatil. Comme lors d'une distillation simple, les vapeurs sont condensées pour obtenir un produit A pur, collecté dans un premier récipient. La solution liquide (dans le ballon) est alors exempte du produit A. On change le récipient de récupération et on augmente la température du mélange liquide afin de recueillir chaque constituant séparément (B, C, ...). On repère plusieurs paliers de température correspondant à la vaporisation des différents constituants du mélange initial. On a donc autant de paliers de température que de constituants.
Souvent, les liquides à séparer ont soit des températures d'ébullition très proches, soit de grandes affinités.
Lorsque les vapeurs montent dans la colonne de séparation, elles se refroidissent et se condensent sur la surface interne de la colonne (les aiguilles de la colonne de Vigreux). Ce liquide est ensuite chauffé progressivement par les autres vapeurs montantes jusqu'à être vaporisé à nouveau. Toutefois, la composition de ces nouvelles vapeurs n'est pas la même que celle des vapeurs initiales, elles sont plus concentrées en le composant le plus volatil.
Chaque cycle de vaporisation-condensation se produisant au sein de la colonne de séparation (appelé un plateau théorique) conduit à une augmentation de la concentration en le composé le plus volatil. On peut donc caractériser la colonne par son nombre de plateaux théoriques : plus celui-ci est élevé, plus la colonne sera capable de fractionner le mélange avec finesse.
Manipulation : en binôme
Faire une distillation fractionnée d'un mélange eau/acétone (50/50).
1 Introduire dans le ballon 100mL du mélange à distiller.
2 Effectuer la distillation : il doit s'écouler une goutte par seconde. Le réglage s'effectue grâce à l'élévateur.
3 Noter la température de départ à froid et dès la première goutte.
4 Noter la température tous les 5mL de distillat recueilli.
Vous devriez pouvoir recueillir l'acétone dans une première éprouvette graduée et l'eau dans une seconde éprouvette graduée !
Conseil : Faites -vous aider de votre enseignant éventuellement ! Contrairement à vos camarades qui font la distillation simple, il devrait vous être assez aisé de savoir quand changer d'erlenmeyer !
Schéma du montage :
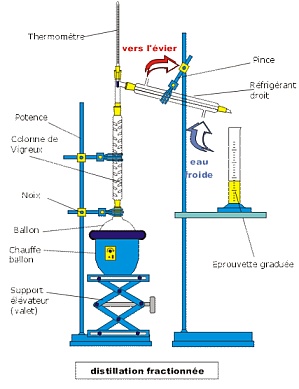
Le montage doit se faire dans le même ordre que celui donné pour la distillation simple, en intercalant la colonne de Vigreux.
Le démontage se fera en sens inverse.
Compte rendu :
Pour tous les groupes :
1. Dessiner le montage de la distillation simple et de la distillation fractionnée.
2. Tracer la courbe q = f(Vdistillat) sur du papier millimétré correspondant au montage que vous avez effectué.
3. Noter vos observations.
4. Comparer les courbes. Quel est l'intérêt de faire une rectification ?
En fonction du temps les courbes peuvent être faites sur un traceur de courbe (ex : régressi)
information(s) pédagogique(s)
niveau : 1ère STL, 1ère S
type pédagogique : travaux pratiques
public visé : élève
contexte d'usage : laboratoire
référence aux programmes :
Module chimie
Réaliser
fichier joint
information(s) technique(s) : Fichier modifiable au format . doc
taille : 136 kio ;
ressource(s) principale(s)

|
programme 2011 de 1ère STL - option SPCL | 18/09/2011 |
| un dossier complet sur le programme 2011 de classe de première de la série STL (option Sciences Physiques et Chimiques en Laboratoire). | ||
| réforme,1STL, 1SPCL, labo | ||

|
programme 2011 de 1ère S | 22/07/2011 |
| un dossier complet sur le programme 2011 de première S en sciences physiques et chimiques. | ||
| réforme,1S | ||
physique chimie - Rectorat de l'Académie de Nantes

 s'identifier
s'identifier
 portail personnel ETNA
portail personnel ETNA



![ressources 2nde [legende-image]1424145819776[/legende-image]](/medias/photo/screenhunter-713-oct-21-17-32_1571671942522-jpg)
![ressources 1ère [legende-image]1424145819779[/legende-image]](/medias/photo/screenhunter-715-oct-21-17-36_1571672254646-jpg)
![ressources Terminale [legende-image]1424145819780[/legende-image]](/medias/photo/screenhunter-716-oct-21-17-52_1571673229637-jpg?ID_FICHE=553319)
![des sites de ressources [legende-image]1424145819708[/legende-image]](https://www.pedagogie.ac-nantes.fr/medias/photo/logositeinternet_1571594339938-png)
